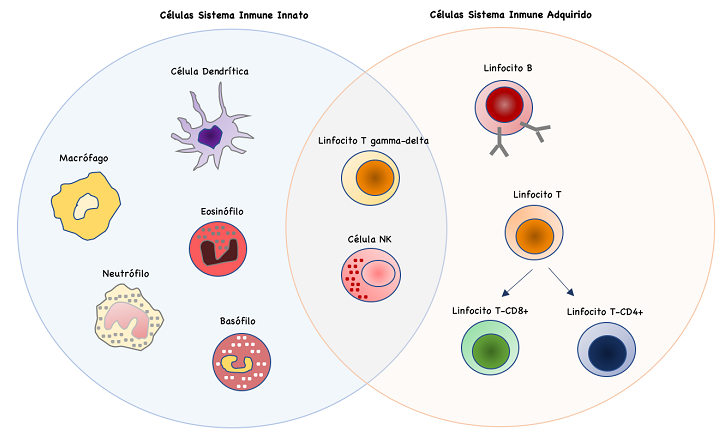
RESPUESTA INMUNE
El sistema inmunitario nos defiende constantemente frente a agresiones procedentes del exterior, así como del propio organismo, con el fin de mantener la integridad biológica de nuestro organismo. Todos los mecanismos de defensa de los cuales nuestro sistema inmunitario dispone y pone en marcha para proteger a nuestro organismo se pueden agrupar bajo el término de respuesta inmune.
Hay dos tipos de respuesta inmune, que aunque distintas, actúan de manera coordinada e integrada:
Respuesta inmune innata (natural, inespecífica).
Respuesta inmune adaptativa (adquirida, específica).
Aunque la forma de proceder de estas dos respuestas es semejante, es importante comprender la diferencia existente entre ellas, para entender mejor el funcionamiento del sistema inmunitario.
- Prepare cuidadosamente al paciente y seleccione la mejor disponibilidad HLA compatible con el tipo de sangre ABO para la donación de órganos.
- Emplee terapia inmunosupresora múltiple; use varios agentes simultáneamente, cada uno de los cuales se dirige a un objetivo molecular diferente dentro de la respuesta del aloinjerto. Los efectos sinérgicos permiten el uso de varios agentes a dosis relativamente bajas, y mientras limitan las toxicidades específicas maximizan el efecto inmunosupresor.
- Emplee protocolos de fármaco de mantenimiento de dosis bajas e inducción intensiva; se requiere una mayor inmunosupresión para obtener un injerto temprano o para tratar el rechazo establecido que para mantener la inmunosupresión a largo plazo. El alto riesgo de rechazo agudo es causado por el mayor riesgo de efectos secundarios, lo que requiere una reducción lenta de los medicamentos inmunosupresores de mantenimiento.
- Se requiere una investigación de cada episodio de disfunción del trasplante, incluyendo la evaluación de la recurrencia de la enfermedad, el rechazo, la toxicidad de los medicamentos, y la infección (teniendo en cuenta que los diversos problemas pueden y coexisten a menudo).
- Reduzca la dosis o suspenda el medicamento si la toxicidad excede los beneficios.
Terapia de inducción biológica
En muchos centros de trasplante, la terapia de inducción con agentes biológicos se utiliza para retrasar el uso de los inhibidores de la calcineurina nefrotóxica o para intensificar la terapia inmunosupresora inicial en pacientes con alto riesgo de rechazo (es decir, los trasplantes de repetición, los pacientes en términos generales presensibilizados, los pacientes afroamericanos o pacientes pediátricos). Esta estrategia ha sido un importante componente de la inmunosupresión desde 1960, cuando Starzl y sus colegas demostraron el efecto beneficioso de la globulina antilinfocítica (ALC, antilymphocyte) en la profilaxis del rechazo. Dos preparaciones son aprobadas por la FDA para su uso en el trasplante: inmunoglobulina de linfocitos (Atgam) y globulina antitimocítica (ATG; timoglobulina) (Brennan et al., 2006; Nashan, 2005). El ATG es el agente agotador usado más frecuentemente. El alemtuzumab, un mAb humanizado anti-CD52 que produce agotamiento linfocítico prolongado, está aprobado para uso en la LLC y MS, pero se utiliza cada vez más fuera de la etiqueta como terapia de inducción en el trasplante (Jones y Coles, 2014).
Inmunoterapia de mantenimiento
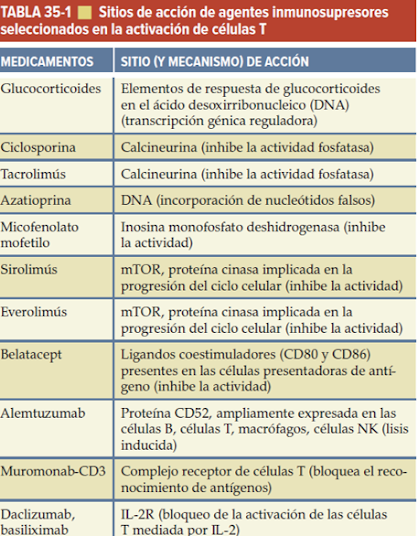
La terapia básica inmunosupresiva utiliza múltiples fármacos simultáneamente, un inhibidor de calcineurina, glucocorticoides, y micofenolato un inhibidor del metabolismo de las purinas), cada uno dirigido a un paso discreto en la activación de las células T Vincenti et al., 2008). Los glucocorticoides, la azatioprina, la ciclosporina, el tacrolimús, el micofenolato, el sirolimús, el belatacept y varios mAb y anticuerpos policlonales son todos aprobados para su uso en el trasplante.
Terapia para el rechazo establecido
Las dosis bajas de prednisona, inhibidores de la calcineurina, inhibidores del metabolismo de la purina, sirolimús, o belatacept son eficaces en la prevención del rechazo celular agudo; son menos efectivos para bloquear los linfocitos T activados y, por tanto, no son muy eficaces contra el rechazo agudo o para la prevención total del rechazo crónico. Por tanto, el tratamiento del rechazo establecido requiere el uso de agentes dirigidos contra las células T activadas. Éstos incluyen los glucocorticoides en dosis altas (terapia de pulso), los anticuerpos policlonales antilinfocitos, o muromonab- CD3 (bajo licencia de la FDA, pero actualmente no comercializado en Estados Unidos debido al uso disminuido).
Glucocorticoides
La introducción de glucocorticoides como fármacos inmunosupresores en la década de 1960 desempeñó un papel clave en posibilitar el trasplante de órganos. La prednisona, prednisolona y otros glucocorticoides se usan solos y en combinación con otros agentes inmunosupresores para el tratamiento del rechazo de trasplantes y enfermedades autoinmunes.
Mecanismo de acción
Los glucocorticoides tienen amplios efectos antiinflamatorios en varios componentes de la inmunidad celular, pero relativamente poco efecto sobre la inmunidad humoral. Los glucocorticoides se unen a receptores dentro de las células y regulan la transcripción de otros muchos genes. Los glucocorticoides también reducen la activación NF-κB, suprimen la formación de citocinas proinflamatorias tales como IL-1 e IL-6, los linfocitos T se inhiben a partir de la síntesis de IL-2 y la proliferación de linfocitos T, e inhiben la activación de los CTL. Además, los neutrófilos y los monocitos tratados con glucocorticoides muestran pobres quimiotaxis y una menor liberación de enzimas lisosómicas.
Usos terapéuticos
Existen numerosas indicaciones terapéuticas para los glucocorticoides. Comúnmente se combinan con otros agentes inmunosupresores para prevenir y tratar el rechazo de trasplantes. Los glucocorticoides también son eficaces para el tratamiento de GVHD en el trasplante de médula ósea. Los glucocorticoides se usan rutinariamente para tratar trastornos autoinmunes tales como artritis reumatoide y otras artritis, lupus eritematoso sistémico, dermatomiositis sistémica, psoriasis y otras afecciones de la piel, asma bronquial y otros trastornos alérgicos, enfermedad inflamatoria del intestino, enfermedades inflamatorias oftálmicas, trastornos hematológicos autoinmunes, y exacerbaciones agudas de la MS.
Toxicidad
El uso amplio de glucocorticoides a menudo da como resultado efectos adversos discapacitantes que amenazan la vida. Estos efectos incluyen el retraso del crecimiento en niños, necrosis avascular de hueso, osteopenia, aumento del riesgo de infección, mala cicatrización de las heridas, cataratas, hiperglucemia e hipertensión.
INHIBIDORES DE LA CALCINEURINA
Los fármacos inmunosupresores más eficaces en el uso rutinario son los inhibidores de calcineurina ciclosporina y tacrolimús, los cuales se orientan a las vías de señalización intracelular inducida como consecuencia de la activación de TCR.
CICLOSPORINA
Mecanismo de acción: disminuye la respuesta inmunitaria celular, inhibiendo la producción de anticuerpos T- dependientes. También inhibe la producción y liberación de linfocinas, incluyendo interleucina 2.
Dosis: oscila entre 2,5 y 5 mg/kg/día repartida en dos dosis orales.
Usos terapéuticos: trasplante de riñón, hígado y corazón, artritis reumatoide y psoriasis.
Efectos adversos: nefrotoxicidad, temblor, hirsutismo, HTA, hiperlipemia, hiperplasia gingival.
TACROLIMÚS
Mecanismo de acción: inhibición de la activación de los linfocitos-T al unirse a la proteína intracelular FKBP12, formando un complejo que inhibe de forma competitiva la calcineurina.
Dosis:0,15-0,30 mg/kg/día vía oral, dividida en dos tomas separadas12 horas; si no es posible utilizar la vía oral, administrar dosis inicial de 0.03-0,05 mg/kg/día en infusión intravenosa continua durante 24 horas.
Usos terapéuticos: se usa para tratar los síntomas del eccema (dermatitis atópica: una enfermedad de piel que provoca sequedad de la piel y picazón, y algunas veces enrojecimiento y sarpullido escamoso) .
Efectos adversos: dolor de cabeza, diarrea, estreñimiento, náuseas, vómitos, acidez.
MEDICAMENTOS ANTIPROLIFERATIVOS Y ANTIMETABÓLICOS
SIROLIMÚS
Mecanismo de acción: inhibe la activación de los linfocitos T y la proliferación en un punto posterior de los receptores de IL-2 y otros receptores del factor de crecimiento de las células T.
Dosis: dosis recomendada es de 6 mg administrada tan pronto como sea posible después del trasplante, seguida de 2 mg una vez al día.
Usos terapéuticos: se usa en combinación con otros medicamentos para prevenir el rechazo de los trasplantes renales.
Efectos adversos: en T. Riñón: dislipidemia mixta, anemia leucopenia trombocitopenia, hipo o hiperpotasemia fiebre trastornos GI, solo NO es nefrotóxico.
EVEROLIMÚS
Mecanismo de acción: inhibe la estimulación antigénica e inducida por la interleucina (IL-2 e IL-15) y la proliferación de los linfocitos T y B.
Dosis: la dosis recomendada es de 10 mg de everolimús una vez al día. Deberá continuarse el tratamiento mientras se observe beneficio clínico o hasta que se presente una toxicidad inaceptable.
Usos terapéuticos: se utiliza para tratar carcinoma de células renales avanzado, que ya ha sido tratado sin éxito con otros medicamentos.
Efectos adversos: pérdida de peso, boca seca, debilidad, dolor de cabeza.
AZATIOPRINA
Mecanismo de acción: la producción de 6-MP que actúa como un antimetabolito de las purinas. El posible bloqueo de grupos -SH mediante alquilación.
Dosis: enfermedad Inflamatoria Intestinal: 0.5mg/Kg/día e incrementar cada 10 días hasta alcanzar la dosis efectiva de 2-3 mg/kg/día.
Usos terapéuticos: rechazo trasplante (3 5 mgs /Kg/día), artritis reumatoidea (1 mgs /Kg/día).
Efectos adversos: mayor frecuencia de infecciones, hepatotoxicidad, alopecia, pancreatitis, mayor peligro de neoplasias.
MICOFENOLATO MOFETILO
Mecanismo de acción: inhibidor selectivo, no competitivo, irreversible de la IMPDH, inhibe la vía de síntesis de novo de Guanina, inhibe proliferación de Linfocitos (funciones).
Dosis: DOSIS: 1 gramo oral o EV (en 2 hrs ) 2.v.d. (1.5 g. Trasplante hígado o cardio Negro).
Usos terapéuticos: rechazo trasplante junto a Corticoides o inhibidor de calcineurina NO con Azatioprina, LES.
Efectos adversos: leucopenia, diarrea, vómitos, infecciones por Citomegalovirus.
ANTICUERPOS DE INMUNOSUPRESIÓN Y PROTEÍNA DEL RECEPTOR DE FUSIÓN
Los policlonales y mAb contra los antígenos de superficie de los linfocitos son ampliamente utilizados para la prevención y el tratamiento del rechazo del trasplante de órganos. Los antisueros policlonales se generan mediante inyecciones repetidas de timocitos humanos (ATG) o contra linfocitos (ALG) en animales y purificando después la fracción de inmunoglobulina del suero. Estas preparaciones varían en eficacia y toxicidad de lote a lote. Se ha demostrado que la capacidad de producir mAb, son los problemas de eficacia y toxicidad más variables vistos con los productos policlonales, pero los mAb se limitan más a sus objetivos específicos. La primera generación de anticuerpos de murinos de mAb se ha reemplazado con los anticuerpos monoclonales humanizados o completamente humanos más recientes que carecen de antigenicidad, tienen una t1/2 prolongada, y pueden ser objeto de mutagénesis para modificar su afinidad por los receptores Fc.
GLOBULINA ANTITIMOCITO
Mecanismo de acción: la globulina antitimocítica contiene anticuerpos citotóxicos que se unen a CD2, CD3, CD4, CD8, CD11a, CD18, CD25, CD44, CD45 y HLA clases I y II en la superficie de las moléculas de los linfocitos T humanos.
Usos terapéuticos: indicada para la inducción de la inmunosupresión, aunque las indicaciones aprobadas son sólo para el tratamiento y la profilaxis del rechazo del trasplante renal agudo en combinación con otros agentes inmunosupresores y para el tratamiento de la anemia aplásica.
ANTICUERPOS MONOCLONALES
Inmunoterapia y la naturaleza de la coestimulación y la inhibición
Múltiples moléculas coestimuladoras e inhibidoras interactúan para regular las respuestas de las células T. La activación de la inmunización requiere dos señales que emanan de la interacción de proteínas de membrana en APC y células T. Un número creciente de anticuerpos dirigidos a estas proteínas que interactúan permite la interrupción de la activación inmune para producir un estado de supresión inmune.
ANTICUERPOS MONOCLONALES ANTI-CD3
El CD3 es un componente del complejo de TCR en la superficie de los linfocitos T humanos. Los anticuerpos dirigidos a la cadena ε de CD3 se han usado con considerable eficacia en el trasplante humano. El anticuerpo anti-CD3 es monoclonal y se dirige a la cadena CD3 del TCR, induciendo su endocitosis y la inactivación y eliminación de células T a través de la fagocitosis. El original IgG2a de ratón antihumano CD3 mAb, muromonab-CD3 (OKT3) ya no es comercializado debido a los efectos secundarios: es frecuentemente causa del síndrome de liberación de citocinas y edema pulmonar grave. Sin embargo, el muromonab sigue registrado por la FDA y podría reintroducirse en el mercado en cualquier momento.
ANTICUERPO MONOCLONAL ANTI-CD52 (alemtuzumab)
El alemtuzumab es un mAb anti-CD52 humanizado que se está agotando.
Mecanismo de acción: el alemtuzumab se une a la proteína CD52 que se expresa de forma salvaje en los linfocitos B y T, así como en los macrófagos, células NK y algunos granulocitos. La unión del alemtuzumab a CD52 induce la lisis de las células dependientes del anticuerpo y una leucopenia profunda que puede durar más de un año.
Usos terapéuticos: el alemtuzumab se usa principalmente para la inducción de la terapia inmunosupresora y permite evitar las dosis altas de esteroides. Para los trasplantes, el régimen más común es una sola dosis intraoperatoria de 30 mg.
ANTICUERPOS ANTIRRECEPTORES DE IL-2 (anti-CD25)
El daclizumab es un mAb quimérico de IgG1 humana/región que determina la complementariedad, de origen murino humanizado. El basiliximab es un mAb quimérico murino humano. Ambos tienen licencia para su uso conjuntamente con la ciclosporina y los corticosteroides para la profilaxis del rechazo agudo de órganos en pacientes que reciben trasplantes renales.
Mecanismo de acción: el mAb anti-CD25 se une con alta afinidad a la subunidad α del receptor de IL-2 y actúa como un antagonista del receptor, inhibiendo la activación de los linfocitos T y la proliferación sin inducir la lisis celular. El daclizumab tiene una afinidad algo menor, pero tiene una semivida más larga (20 días) que el basiliximab. Además, la inducción de linfocitos T CD56+ y CD4+ se asocia con la respuesta a la terapia en pacientes con EM.
Usos terapéuticos. los mAb anti-CD25 se usan para la terapia de inducción en el trasplante de órganos sólidos. También se encuentran en ensayos clínicos de fase 3 en pacientes con EM. La t1/2 larga de daclizumab (20 días) da como resultado la saturación de los linfocitos circulantes de IL-2Rα hasta 120 días después del trasplante.










Creo que esta información esta super detallada y super interesante.
ResponderEliminarExcelente información, esta muy entendible abarcando los principales inmunosupresores.
ResponderEliminarBuen resumen. Gracias por compartir.
ResponderEliminarLa información está muy interesante muy bien la forma de las explicaciones
ResponderEliminarMuy Buena información
ResponderEliminarEl sistema inmune es algo impresionante, por lo que me deja cautivado la cantidad de información que se colocó
ResponderEliminarResumen muy bien estructurado y entendible.
ResponderEliminarMuy saber de los transplantes y sus medicamentos
ResponderEliminarMuy creativa la información, gracias
ResponderEliminarmuy buen tema
ResponderEliminarmuy bien resumido
ResponderEliminarMuy bien detallada la información, gracias por compartirla.
ResponderEliminarGracias por compartir esta información, un tema muy bien planteado.
ResponderEliminarMuy buena información, aprendí mucho 👍🏻
ResponderEliminarMe gustó mucho este tema el sistema inmune es algo increíble gracias por compartir una información muy bien elaborada
ResponderEliminarTodo muy bien explicado y material de apoyo excelente!!
ResponderEliminarExcelente manera de exponer este tema de suma importancia para la atención integral en salud de toda la población. muy buen blog!
ResponderEliminarMe gustó que dieras con detalle cada médicamento, para que sirve y sus efectos adversos.
ResponderEliminarExcelente ����.
Excelente información me encantó!!
ResponderEliminarBuen desarrollo del tema, me encanta
ResponderEliminarInteresante tema
ResponderEliminarExcelente información
ResponderEliminarExcelentes aportes, y muy buena distribución de la información!!!
ResponderEliminarUn tema muy interesante, muy comprensible y organizado, excelente trabajo.
ResponderEliminar